천연물항암제
| 용도 | 제형 | 기타 | 보건구분 |
|---|---|---|---|
임상시험 의약품 |
분말주사제 | 복막전이암 2상 진행중 |
전문의약품 |
에스비주사 작용기전
(1) Inhibition the expression of HIF-1α and vascular endothelial growth factor in various cancer cells
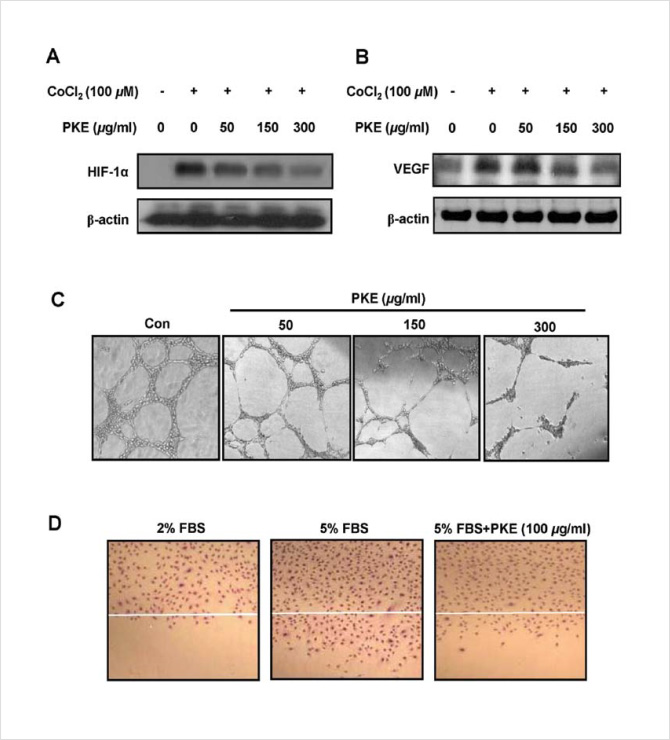
Figure.1. Effect of PKE(Pulsatilla koreana extract) on angiogenesis of Huh-7 cells.
- (A) Expression of HIF-1α and (B) VEGF by PKE in hypoxia-indu-ced Huh-7 cells (CoCl2, 100 μM).
- (C) Effects of PKE on tube formation in vitro. HUVECs were pl- ated on Matrigel (200 μl/well) and treated with various co- ncentrations of PKE. Capillary tube formation was assessed after 14 h. Tube formation was observed under a phase- contrast microscope and photographed at x400 magnifica- tion.
- (D) Effects of PKE on migration in vitro. HUVECs were plated at 90% confluence and a scratched was made with a razor blade. After wounding, the cells were washed with a serum -free me-dium and incubated in M199 with 5% FBS and 5 ng/ml bFGF, 1 mM thymidine and/or PKE (100 μg/ml). M199 medium with 2% FBS was used as negative control. Data represent the mean of at least three independent ex periments done in triplicate.
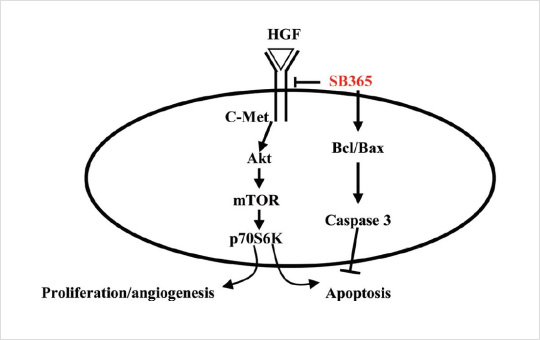
(2) Inhibition the c-Met/Akt/mTOR signaling pathway in various cancer cells
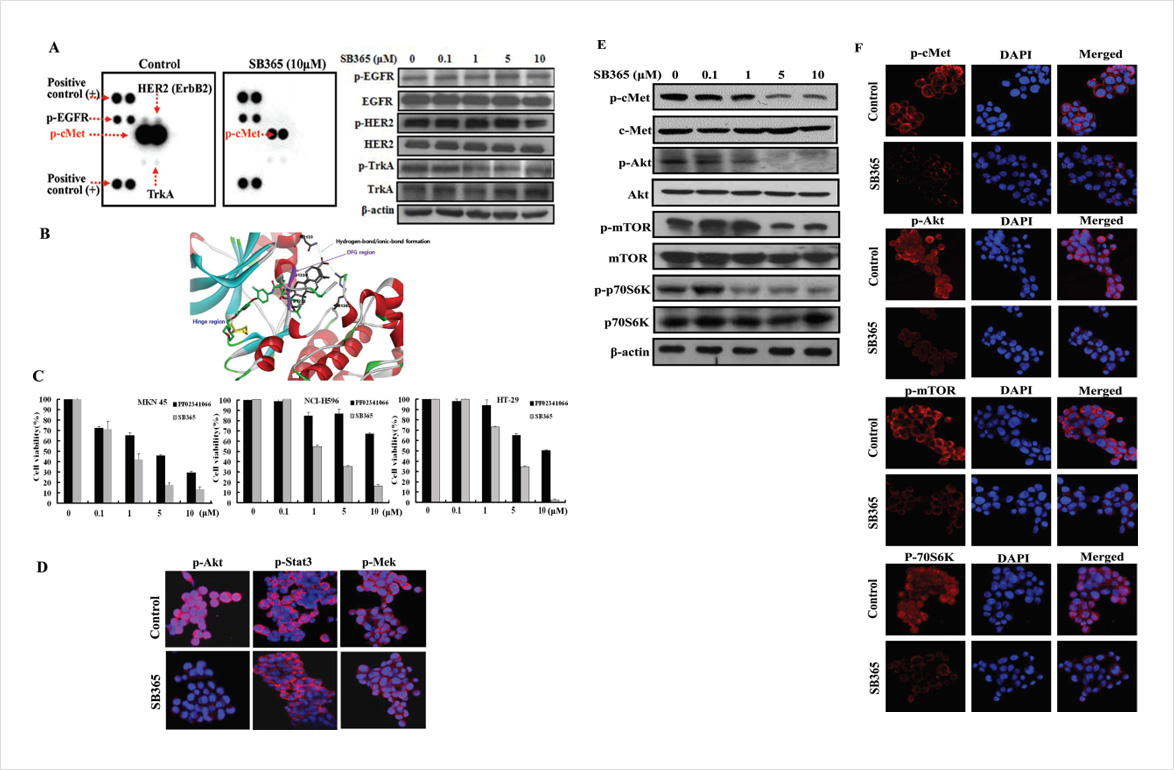
Fig.2. c-Met inhibition by SB365.
- (A) Phosphorylation of RTKs by SB365 and expression of phospho-human epidermal growth factor receptor 2, phosphoepidermal growth factor receptor and phospho-neurotrophic tyrosine kinase receptor by SB365 in MKN-45 gastric cancer cells.
- (B) Proposed structure for the c-Met complex with the aglycone of SB365 (the original crystal ligand: green; the aglycone of SB365: gray). H-bonding interacti-ons between the aglycone of SB365 and c-Met are shown in green dotted lines. The DFG moiety of c-Met was indicated in a magenta ribbon.
- (C) Effects of SB365 in c-Met alteration cells. The growth of the cells (MKN-45 gastric cancer cells; c-Met amplification cells, NCI-H596 non-small cell lung cancer cells; c-Met splicing mutation cells and HT-29 colon cancer cells; c-Met overexpression cancer cells) were measured by the 3-(4,5-dimethylthiazole- 2-yl)-2,5-diphenyl tetrazolium bromide assay.
- (D) Inhibition of p-Akt, p-STAT3 and p-Mek by SB365 in MKN-45 gastric cancer cells.
- (E) Effect of SB36 on the c-Met/AKT/mTOR pathway in MKN-45 gastric cancer cells. The cells were treated with SB365 at various doses (0.1–10 μM). Western blotting experiments for p-Akt, p-mTOR and p-p70S6K were performed with the cell lysates.
- (F) Immunofluorescent imaging at ×400 magnification of c-Met/Akt/mTOR target proteins after treatment with SB365 is shown. Anti-rabbit antibodies against p-Akt, p-mTOR and p-p70S6K were used for labeling. DAPI was used to counter stain the nucleus.
혈관 신생 인자인 VEGF와 그의 조절인자인 HIF-1α의 발현 결과
혈혈관신생(angiogenesis)은 모세혈관내피세포의 증식으로, 여러 종양의 발생, 성장뿐만 아니라 전이에까지 중요한 영향을 미친다. 종양세포에서 분비되는 혈관신생물질은 paracrine manner로 혈관내피세포에 작용하여 내피세포의 증식, 종양세포의 침윤을 유도하여 종양혈관형성에 관여하는데 혈관신생요소(angiogenic factor)로서 platelet-derived growth factor(PDGF), basic fibroblastic growth factor(bFGF) 및 vascular endothelial growth factor(VEGF), epidermal growth factor 및 transforming growth factor β 등이 알려져 있다. 이 중에 대표적인 혈관 신생 인자인 VEGF와 그의 조절인자인 HIF-1α의 발현에 미치는 영향을 알아보았다. 세포내 저산소 상태를 mimic할 수 있는 CoCl2를 처리하였을 때 대조군에 비해 VEGF와 HIF-1α의 양이 증가하였고, SB 주사액을 처리하였을 때, HIF-1α의 경우 100㎍/㎖에서부터 VEGF의 경우 300㎍/㎖에서 발현양이 감소하는 것을 확인할 수 있었다.
Apoptosis의 표지자인 PARP와 cleaved caspase-3 발현 결과
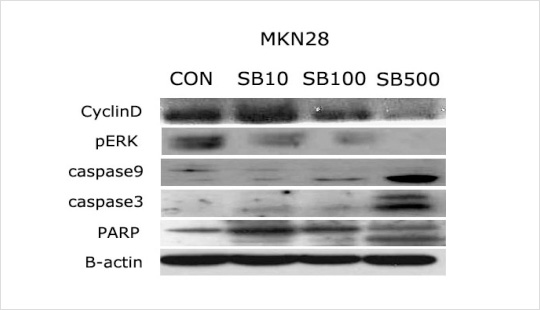
Cyclin D1은 G1/S이행기에 세포주기 진행에 매우 중요한 역할을 하는 oncoprotein으로 암세포 생존에 필수적이다. MKN28 세포에 SB 주사제을 처리하였을 때 Cyclin D1의 발현 이 농도 의존적으로 현저히 감소되었다. 또한 인산화형의 ERK가 SB 주사제 처리에 의해 농 도의존적으로 감소하였다. 이는 ERK가 MKN28 세포에서 세포생존 및 유지와 관련된 단백 질의 인산화에 계속적으로 관여하고 있다는 사실을 암시한다.
Cysteine-dependent aspartate-directed protease인 caspase는 세포 내 단백질의 분 절에 주요한 역할을 하며 이를 통해 death signal을 전달한다. Caspases는 세포내에서 불 활성 형태인 proenzyme으로 합성된 후 스스로 또는 다른 caspase에 의해 분절되어 활성 화된다. 현재 14종류의 caspase가 알려져 있고 그 중 7종의 caspase가 apoptosis에 깊게 관여하며 크게 initiator caspase(caspase-8, -9, -2, -10)와 effector caspase(caspase-3, -7, -6)로 분류할 수 있다. Initiator caspase인 caspase-8과 -9은 각각 death effector domain(DED)과 caspase recruitment domain(CARD)을 지니고 있으며 서로 다른 경로를 통해 활성화된다. Death receptor에 ligand가 결합하면 caspase-8을 끌어당겨 활성화시킨다. 활성화된 caspase-8은 직접 caspase-3를 활성화시키거나 또는 Bid의 분절, t-Bid의 미 토콘드리아로의 이동을 유발시켜 미토콘드리아 막투과성을 증가시키고 이를 통해 apoptosis를 유도한다. 반면 caspase-9은 미토콘드리아에서 방출된 cytochrome c에 의해 활성화 되어 caspase-3를 활성화시킨다. 이렇게 활성화된 caspase-3는 caspase-7을 활성화시키고 활성화된 effector caspase들은 lamin A, PARP, DNA fragmentation factor등의 단백 질을 분해하여 apoptosis를 유도한다. 이처럼 apoptosis에 있어 중요한 역할을 하는 caspase의 활성에 미치는 SB주사액의 효과를 조사하기 위하여 caspase의 활성형태인 cleaved caspase 단백질들의 발현을 조사하였다. 그 결과 initiator caspase인 cleaved caspase-9은 SB 주사제 500ug/ml 농도에서 증가하였다 또한 effector caspase인 caspase-3의 cle- aved form도 SB 주사제 500ug/ml 농도에서 현저하게 증가하였다.
Caspase-3에 의해 분해되어 불활성화되는 것으로 알려진 PARP는 DNA 복구와 유전자 보전에 관련된 세포 핵 내 단백질로 DNA 손상을 신호로 base-excision repair에 관여한다. 활성화된 PARP는 NAD를 기질로 poly(ADP-ribose)를 형성하여 핵 내에 존재하는 다양한 단백질 및 효소를 변형시켜 DNA를 회복시킴으로써 세포의 생존 유지에 중요한 역할을 담당 한다. PARP의 분절로 인한 불활성화는 세포 분해를 촉진함으로 cleaved PARP의 증가는 세포가 apoptosis되고 있음을 나타낸다. caspase 단백질들의 활성화를 일으킨 SB 주사제가 PARP 단백질의 분절에 미치는 영향을 Western blot을 통해 살펴보았다. 위의 그림에서 볼 수 있듯이 SB 주사제의 농도가 증가할수록 cleaved PARP 단백질이 현저하게 증가함을 알 수 있다. 이는 SB 주사제에 의한 PARP의 불활성화가 apoptosis에 기여함을 알 수 있다.
이상의 결과들을 통해 SB 주사제는 위암세포인 MKN28 세포에서 caspase-9, -3의 활성 증가에 의해 PARP를 불활성화시킴으로써 apoptosis를 유도함을 확인할 수 있었다. 최근에는 강력한 PARP-1 억제제를 암환자의 임상시험으로도 사용하고 있어 PARP를 억제함으로써 apoptosis를 유도한 SB 주사제는 향후 화학적 암예방 물질이나 치료제로 개발될 가능성을 지님을 제시한다.
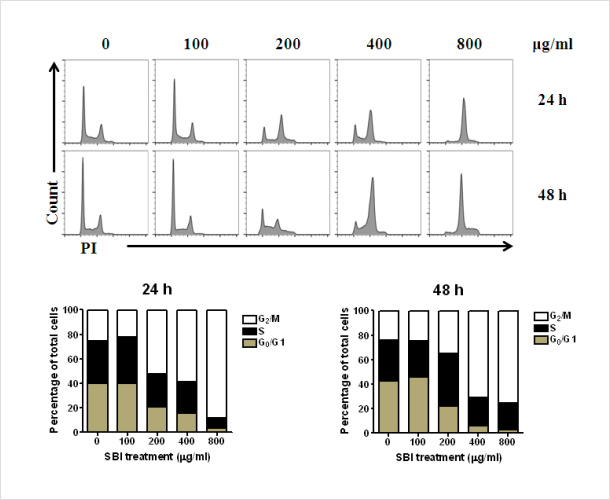
(3) Cell cycle 분석을 통한 SB injection의 G2/M arrest 유도 확인
- T98G에 SB injection을 농도별로 처리한 후, cell cycle을 분석한 결 과, SB injection의 농도 의존적으로 T98G에서 G2/M phase의 arrest가 일어남을 확인함
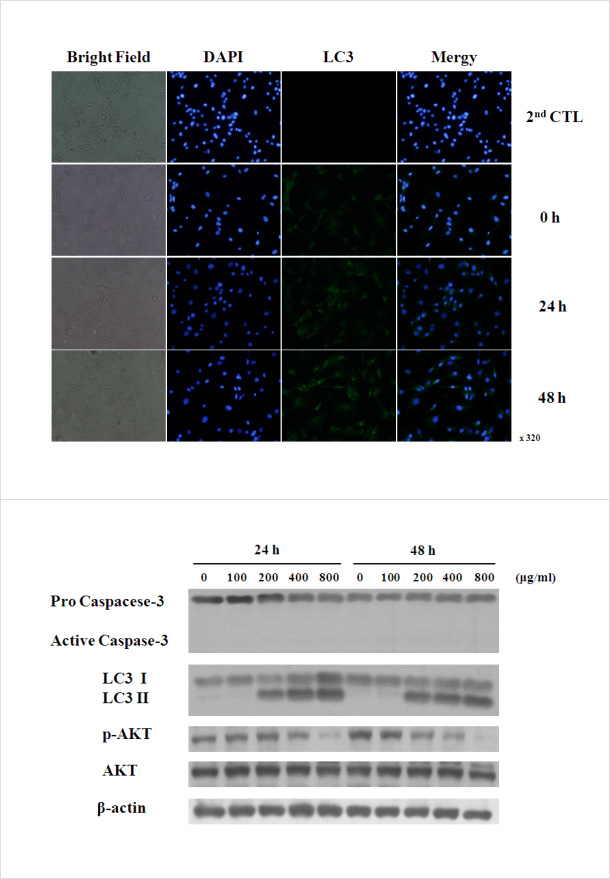
(4) SB injection에 의한 autophagy 유도
- SB injection을 U87-MG에 농도별로 처리한 후 0, 24, 48시간에 auto phagy(자가포식)의 대표적인 마커인 LC-3 발현을 확인하기 위해, 형 광면역염색을 통하여 확인 한 결과, 세포질에 퍼져있던 LC-3의 발현이 SB injection 처리 후 점점 증가함과 동시에, autophagopore형성도 증가되는 것을 확인함
- 또한, SB injection을 U87-MG에 농도별로 처리한 후 24, 48시간에 단 백질을 추출하여 caspase-3와 LC-3, p-AKT/AKT에 대한 Immunob- lot을 수행함
- 그 결과, caspase-3의 cleavage는 관찰되지 않았고, LC-3II는 24, 48 시간 모두 200 μg/ml부터 증가함을 확인함. p-AKT는 24시간에 400 μg/ml, 48시간에는 100 μg/ml 부터 발현이 감소된 것을 확인함
- 따라서, SB injection는 AKT signaling pathway를 억제함으로써 autophagy를 통해 neuroblastoma U87-MG의 세포 사멸을 유도하 는 것임을 확인함